食塩水の電気分解
食塩水の電気分解です。家にある物だけで出来ちゃうので自由研究や暇つぶしにもってこいです!次亜塩素酸ナトリウムの生成
まずは普通に食塩水を一つの容器に入れて電気分解しましょう。準備物
- 金属製以外の容器(プラスチックや陶磁器)
- 9V程度の直流電源(電池等)
- 鉛筆
- 導線
手順
1、鉛筆の木の部分を怪我に気をつけながら削って、芯だけにしたものを二本用意します。2、食塩を水に溶かして食塩水を作り、容器に移します。
3、1を電極として、電源とつなぎます。片方を陽極に、もう片方を陰極につないでください
4、3の鉛筆の部分同士が触れないように、2に差し込むと反応が始まります。

水素、及び塩素が発生します。水素は爆発します。塩素は化学兵器などで使用されます。換気を徹底するか屋外で行ってください。
解説
今回の反応で、最終的に容器に残った液体は、次亜塩素酸ナトリウムです。歯医者さんやプールなどで嗅いだことのある匂いがすると思います。なぜ塩水に電気を流しただけで次亜塩素酸ナトリウムが発生しるのでしょうか?
今回の化学反応式です。
陽極側塩化物イオンが結合して塩素ガスが発生。
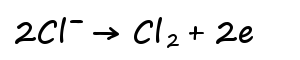
陰極側水素イオンが結合して水素が発生。
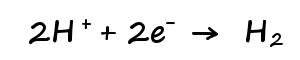
予備反応
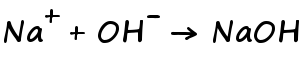
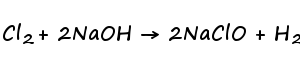
塩化ナトリウムを水に溶かすと、塩化物イオンとナトリウムイオンに電離します。
これに電圧をかけると、当然陽極には塩化物イオンが集まって塩素が発生することは明白ですが、なぜ陰極には金属ナトリウムが析出しないのでしょうか?
それは、簡単に言うとナトリウムの方が水に”溶けやすい”からです。
塩化ナトリウム水溶液中にはナトリウムイオンが存在していますが、電気を流すことによって水は水酸化物イオンと水素イオンとに分解します。
このうち、水素イオンよりナトリウムイオンの方が溶けやすい(正確にはイオン化傾向が強い)ため、個体として析出せず溶けたままイオンとして存在し、陰極には水素イオンが引き寄せられていきます。
結果として、陽極側からは塩素ガスが、陰極側からは水素ガスがそれぞれ発生します。
陰極付近では水溶液中の水酸化物イオンとナトリウムイオンがクーロン力により結合して、水酸化ナトリウムが発生します。
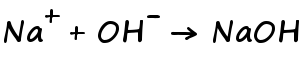
さらに、今回は陽極側と陰極側を分けていませんので、陰極に残った水酸化ナトリウムと陽極側に溶けている塩素が反応して次亜塩素酸ナトリウム水溶液が最終的に器の中に残ります。
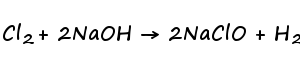
最後に
今回は行いませんでしたが、電気分解装置等使用して陽極側と陰極側を完全に分けて電気分解を行えば、次亜塩素酸ナトリウムの発生は起こらずに水酸化ナトリウム水溶液が得られます。ほかにも、重層と石灰で水酸化ナトリウムを得る方法もあります。水酸化ナトリウムって劇物ですが、意外と簡単にできちゃうものなんですよ!?
今回の実験で発生した水酸化ナトリウムは劇物指定されている、大変危険な物質です。決して水道に流したり悪用したりしないでください。廃棄方法はお住いの自治体の定める方法に従ってください。